Inhalt Index
Inhalt IndexAls carbocyclisch bezeichnet man Ringmoleküle, deren Ringe nur aus Kohlenstoffatomen aufgebaut sind. In den sogenannten Heterocyclen ist mindestens ein Kohlenstoff des Rings durch ein Heteroatom wie N, O oder S ersetzt. Über die Hälfte aller Naturstoffe sind Heterocyclen, und heterocyclische Ringe sind in ausserordentlich vielen pharmakologisch wirksamen Molekülen enthalten.
Die Nomenklatur ist gar nicht so einfach, weil es mehrere Nomenklatursysyteme für Heterocyclen gibt, und Trivialnamen werden auch oftmals verwendet. Oftmals wird die Art des Heteroatoms durch einen Namensvorsatz angegeben ; Aza- für N, oxa- für O, thia- für S.
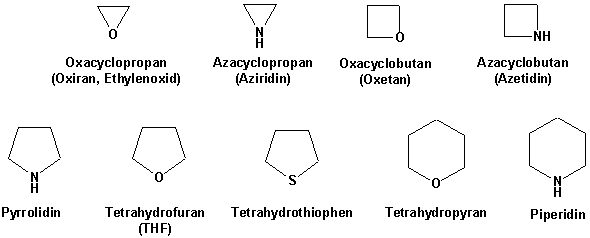
Gesättigte Heterocyclen :
Aromatische Heterocyclen:
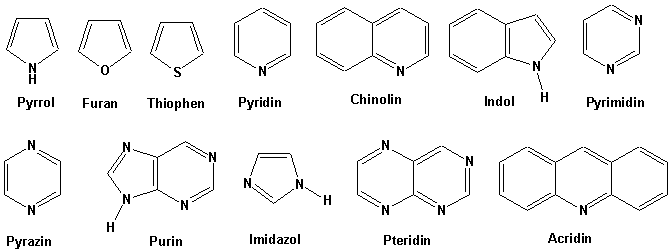
Wir können hier nicht ausführlich die Chemie der aromatischen Heterocyclen diskutieren. Wir werden, jedoch wichtige Aspekte ihrer Strukturen und chemischen Eigenschaften herausgreifen und betrachten.
Durch Ersetzen einer CH-Einheit im Benzol durch einen sp2-hybridisierten Stickstoff erhält man formal das Molekül des Pyridins:
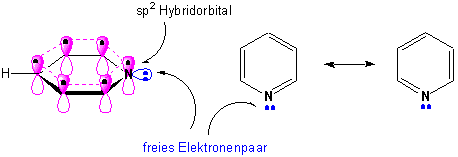
Pyridin ist aromatisch (6π-Elektronen), aber ein freies Elektronenpaar bleibt am Stickstoff und befindet sich in einem der sp2-Orbitale in der Molekülebene.
Weil N elektronegativer als C ist, zieht es induktiv und über Resonanz Elektronendichte aus dem Ring heraus :
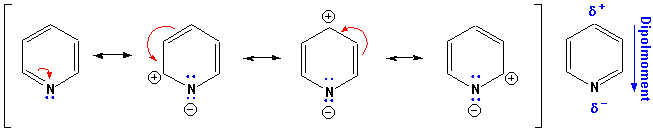
Welche Konsequenzen hat dies für die Reaktivität ?
Zuerst, da das freie Elektronenpaar am N nicht an der Konjugation teilnimmt (es ist nicht in einem p-Orbital, und es gehört auch nicht zu den 6-"aromatischen" Elektronen, vgl. Kapitel 5), reagiert Pyridin als schwache Base:

Das freie Elektronenpaar ist auch für andere Elektrophile zugänglich, wie z.B. (vgl. Kapitel 8):

Daraus entstehen Pyridiniumsalze, die auch in der Natur vorkommen :
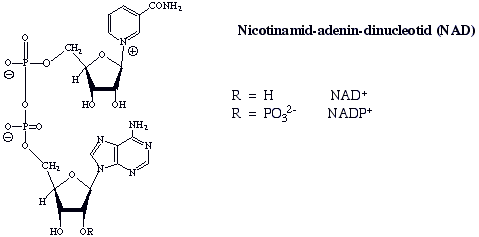
Das Pyridin-nucleotid NAD+ und sein 2"-Phosphat sind Coenzyme in einer Reihe von enzymatisch Oxidations- und Reduktions-Reaktionen. Z.B.:
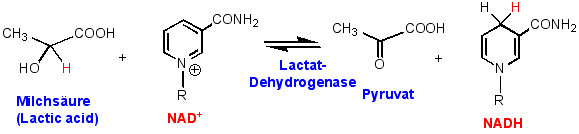
Da der Pyridinring elektronenarm ist, lassen sich elektrophile aromatische Substitution an diesem System nur unter grossen Schwierigkeiten durchführen, und die Reaktionen verlaufen um Grössenordnungen langsamer als bei Benzol, z.B.:
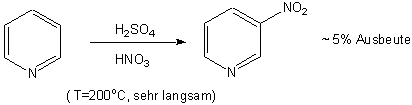
2- und 4-Hydroxypyridine sind von speziellem Interesse, weil sie dabei grösstenteils zum entsprechenden 2- bzw. 4-Pyridon tautomerisieren (vgl. Kapitel 12). Eine Resonanzstruktur zeigt eindeutig ihren aromatischen Charakter:
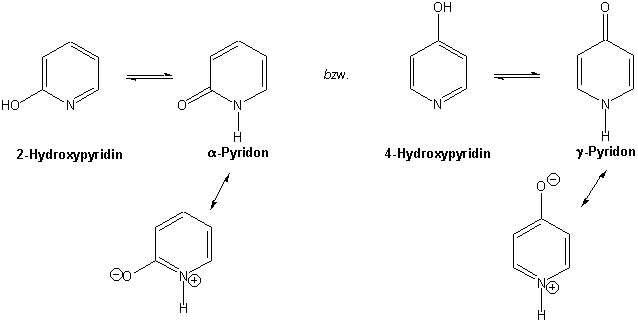
Pyridin ist der einfachste Vertreter der Reihe der Azabenzole, die recht häufig in wichtigen Naturstoffen vorkommen (Siehe auch Kapitel 16):
Die Elektronenstruktur der drei Heterocyclen Pyrrol, Furan und Thiophen ist ähnlich wie die des Cyclopentadienyl-Anions:
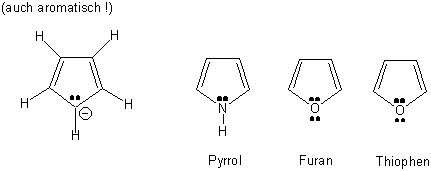
In den entsprechenden Heterocyclen befindet sich ein neutrales Atom mit einem bzw. zwei freien Elektronenpaaren an Stelle eines negativ geladenen Kohlenstoffes :
Molekülorbital-Darstellung
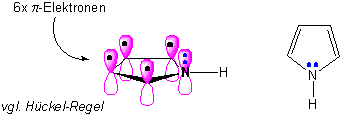
Resonanzstrukturen (Valenzstruktur Beschreibung) :
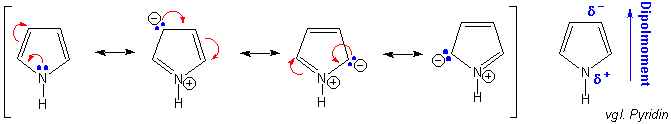
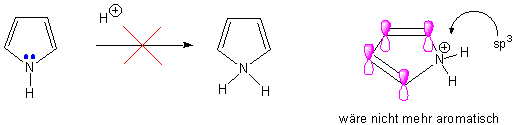
Daraus folgen zwei wichtige Punkte. Erstens: das freie Elektronenpaar an N ist jetzt an den aromatischen 6π-Elektronen beteiligt (vgl. Pyridin). d.h. Pyrrol ist fast gar nicht basisch, im Vergleich zu Pyridin :
Zweitens, es gibt vier dipolare Resonanzstrukturen, in denen sich die positive Ladung auf dem Heteroatom und die negative Ladung an einem jeweils anderen C-Atom befindet (siehe oben). Diesem Bild kann man entnehmen, dass das Heteroatom relativ elektronenarm, die Kohlenstoffatome relativ elektronenreich sein sollten. Tatsächlich wird dies durch das Reaktionsverhalten dieser Verbindungen bestätigt.
Wie man es für aromatische Systeme erwarten kann, gehen Pyrrol, Furan und Thiophen elektrophile aromatische Substitutionsreaktionen ein und sogar viel rascher als Benzol.
Das bedeutendste benzolannelierte Derivat der fünfgliedrigen Heterocyclen ist zweifellos das Indol, das in vielen Naturstoffen enthalten ist :
Molekül-Orbital Bild :
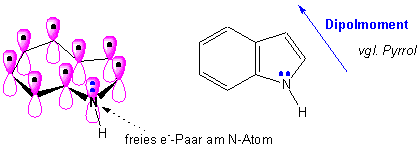
Valenz-Struktur-Bild :
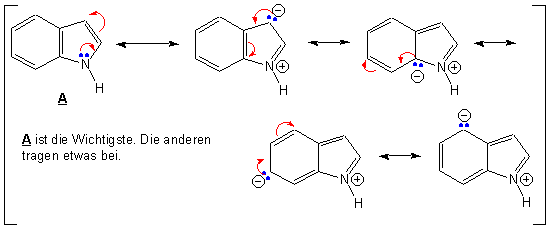
Obwohl die Resonanzstrukturen, bei denen das cyclische 6π-Elektronensystem des annelierten Benzolrings gestört ist, von geringerer Bedeutung sind, zeigen sie den elektronenliefernden Effekt des Heteroatoms.
Indole sind (wie Pyrrol) auch sehr schwache Basen, reagieren aber schnell mit Elektrophilen über elektrophile Substitutionsreaktionen.
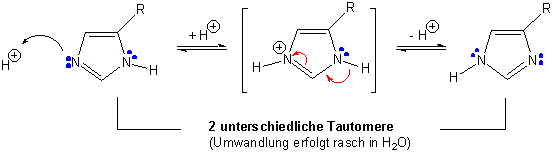
Imidazol ist einer der wichtigsten kleinen Heteroaromaten in der Natur:
Molekül-Orbital Bild: Valenz-Struktur-Bild :
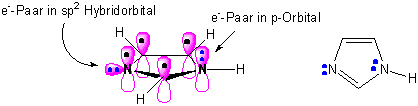
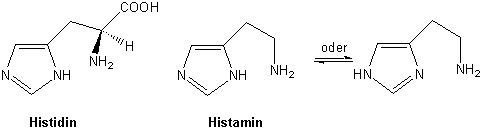
Es kommt in der proteinogenen Aminosäure Histidin (Kapitel 15) vor und ist deswegen von grosser Bedeutung. Durch Decarboxylierung bildet sich das in allen Geweben in kleinen Mengen vorhandene Histamin. Übermässige Mengen von freiem Histamin gelten als Ursache vieler Allergien :
Im Gegensatz zu Pyrrol und Indol ist Imidazol deutlich basisch. Wegen der Stabilität der konjugierten Säure ist Imidazol bedeutend stärker basisch (pKa = 6.5); die Protonierung erfolgt am freien Elektronenpaar des N-Atoms :
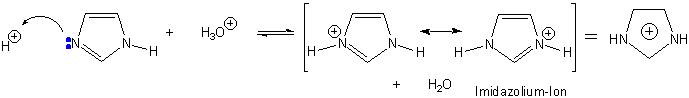
In freier Lösung werden beide möglichen protonierten Formen von z.B. Histidin oder Histamin vorliegen :