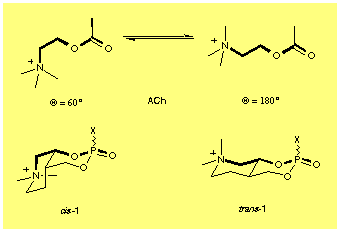
Abbildung 1: Unterschiedliche
Konformationen von Acetylcholin (ACh) und die entsprechenden konformationell
und konfigurativ fixierten Analoga
Schema: mögliche Isomere (Diastereo- und Enantiomere)
P.A. Lorenzetto, A. Strehler, P. Rüedi*
Organisch-chemisches Institut der Universität Zürich, Winterthurerstrasse, 190 CH-8057 Zürich
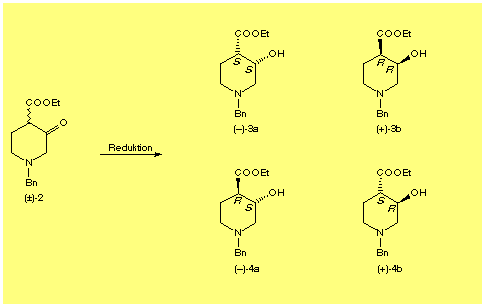
Bei der Synthese von optisch aktiven Acetylcholin-Anologa mit fixierter Konfiguration und Konformation des Typs 1 wurde die Chiralität am Decalin-Gerüst durch enantioselektive Reduktion des beta -Ketoesters 2 entweder durch Hefe oder mittels H2 und (R)- und (S)-BINAP-Ru als Katalysator (sog. Noyori-Katalysator) eingeführt.

Abbildung 1: Unterschiedliche
Konformationen von Acetylcholin (ACh) und die entsprechenden konformationell
und konfigurativ fixierten Analoga

Schema: mögliche Isomere (Diastereo- und Enantiomere)
Durch Reduktion mit NaBH4, Hefe, (R)- bzw. (S)-BINAP-Ru war es möglich, bestimmte Diastereomeren-paare selektiv, jedoch mit stark unterschiedlicher Enantioselektivität herzustellen (siehe Tabelle). Die absolute Konfiguration der Hydroxyester 3 und 4 wurde anhand der Methode von Mosher (1H-NMR) bestimmt. Aus Abb. 2 ist ersichtlich, dass mittels HPLC an optisch aktiver Phase für die unterschiedlichen Reduktionsmethoden reproduzierbare Retenzionszeiten für die gleichen Produkte erhalten werden. Die absolute Konfiguration des cis-Produkts aus der Hefereduktion wurde ebenfalls mittels der Metho-

Abbildung 2: HPLC-Chromatogramm
der versch. Reduktionen (Chiralcel-OD, 250x4.6 mm, Hexan/2-PrOH 12:1, 1
ml/min, 220 nm)

Tabelle: entstehende Hydroxyester 3 und 4 bei den unterschiedlichen Reduktionen
de von Mosher bestimmt und die absolute Konfiguration des
trans-Produkt
aufgrund der bekannten proR/Re-Selektivität der Hefe aus
Analogieüberlegungen
als (3R,4S) (4b) festgelegt. Der direkte Vergleich
mittels HPLC an opt. aktiver Phase (Chiralcel-OD) der Produkte aus
der Reduktion durch die Hefe mit jenen aus der Reduktion mit (R)-
und (S)-BINAP-Ru (siehe Abb. 2 oder Tabelle) ergab,
dass die Hefe nicht das erwartete trans-Produkt 4b sondern
den trans-Hydroxyester 4a ergibt (vgl. Abb. 2).
Sämtliche
Resultate der HPLC-Auswertung sowie der Mosher-Experimente waren
untereinander konsistent.
Zusammenfassung:
Durch diese drei unterschiedlichen Reduktionsmethoden können somit die gewünschten Diastereomeren selektiv hergestellt werden. Die Enantioselektivität der Noyori-Reduktionen ist zur Zeit noch ungenügend, es sollte jedoch möglich sein durch Optimierung der Bedingungen diese zu verbessern. Die Reduktion des Ketoesters 2 durch die Hefe verläuft mit einer Enantioselektivität von 69% ee für das cis-Produkt bzw. 97% ee für das trans-Produkt gut enantioselektiv. Erstaunlich ist zudem das Entstehen des unerwarteten Produkts 4a bei der Hefe-Reduktion mit der (3S)-Konfiguration.