 Inhalt Index
Inhalt IndexDie Ordnungszahl (oder Atomzahl /Atomnummer = Atomic number) ist die Zahl der Protonen im Atomkern. Die Massenzahl (oder Mass number) ist die Summe der Protonen und Neutronen zusammen.
Alle Atome in einem Element besitzen die gleiche Ordnungszahl, aber dürfen verschiedene Massenzahlen haben, z.B.
| H Atomzahl = | 1 | Isotope = | 1H | 2H | 3H | ||||||||||||||||||||||||
99,98 * | 0.015 | 10-16
| C Atomzahl = | 6 | Isotope = | 12C | 13C | 14C
| | | | | 1.1 | 10-10
| N Atomzahl = | 7 | Isotope = | 14N | 15N |
| | | | | 0.37 | |
|
* Natürliche Häufigkeit in Atom-%
Die durchschnittliche Massenzahl heisst Atomgewicht (Atomic weight) und ist normalerweise keine ganze Zahl, z.B.
| H Atomgewicht = | 1.008 |
| C Atomgewicht = | 12.01 |
| N Atomgewicht = | 14.01 |
Besonders wichtig für die Chemie sind die Elektronen. Wo befinden sich die Elektronen ? Aus der Quantenchemie weiss man, dass das Quadrat der Wellenfunktion (ψ2) für jeden Punkt des Raumes um den Kern die Wahrscheinlichkeit beschreibt, ein Elektron an einem bestimmten Punkt zu finden (Die Schrödinger-Gleichung verbindet die Funktion ψ, die Wellenfunktion des Elektrons, mit seiner Energie und den Raumkoordinaten, welche zur Beschreibung des Systems notwendig sind).
Also - in etwas salopper Ausdrucksweise - die Elektronen befinden sich in bestimmten Orbitalen.
Atomorbitale haben eine charakteristische Gestalt.
z.B. für C-Atomen sind nur s - und p- Orbitale wichtig :
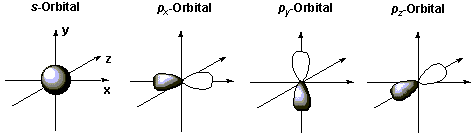
Die Energie-Verhältnisse für die verschiedenen s, p, und d Orbitalen können in einem Energieniveauschema beschrieben werden :
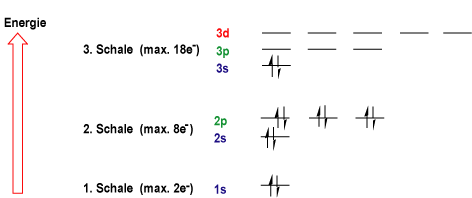 | Quantenzahlen charakterisieren Hauptenergie und Abstand des Elektrons vom Atomkern (n), "orbital shape" (l), Orientierung (m) und Spin (s): n = Hauptquantenzahl l = Neben- oder Orbitalquantenzahl (l=0,1,...n-1) m = mag. Qantenzahl (m = -l..0..+l) s = Spin-Quantenzahl (s = ± ½) |
Bei der "Auffüllung" der möglichen Energieniveaus ist folgendes zu beachten: 1) Die Orbitale mit der niedrigsten Energie werden zuerst aufgefüllt: 2) jedes AO kann mit maximal zwei Elektronen besetzt werden kann, die entgegengesetzten Spin haben müssen (Pauli-Prinzip); 3) Falls zwei oder mehr Orbitale mit der gleichen Energie unbesetzt sind, werden alle Orbitale zuerst mit einem Elektron besetzt, wobei alle Elektronenspins parallel ausgerichtet sind, bis alle Orbitale halb besetzt sind (Hundsche Regel).
Die Elektronenkonfigurationen für verschiedene Elemente können jetzt beschrieben werden. Z.B.:
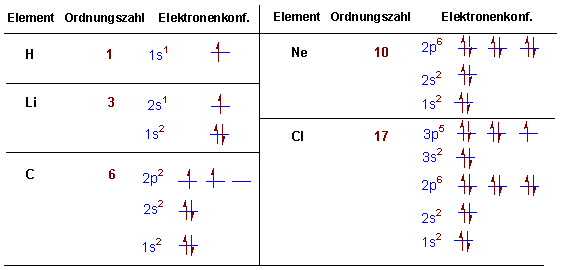
Es ist leicht zu erkennen warum Elektronen-Oktetts und -Duetts besonders stabile Konfigurationen darstellen (Die Edelgasregel). Diese Zahlen von Elektronen ergeben abgeschlossene Konfigurationen mit vollständig besetzten Orbitalen (vgl. He, Ne Ar, Kr, Xe, Rn).
Warum bilden Atome Bindungen miteinander ? Grob gesagt, weil das resultierende Produkt stabiler ist (besitzt weniger Energie) als die getrennten Atome.
Eine einfache Ionenbindung entsteht zwischen einem elektronegativen Atom (elektronegatives Atom bedeutet ein Atom, das eine Tendenz besitzt, Elektronen an sich zu ziehen) und einem elektropositiven Atom ( d.h. einem Atom, das die Tendenz hat, Elektronen zu übertragen).
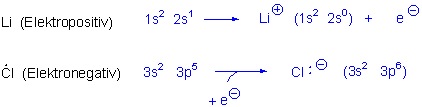
Eine Ionenbindung kommt durch elektrostatische Anziehungskräfte zwischen den geladenen Ionen zustande.
Elemente an der ganz rechten und an der ganz linken Seiten des Periodensystems bilden also Ionenbindungen durch den Verlust beziehungsweise Gewinn von Elektronen.
Das Kohlenstoffatom (1s2 2s2 2p2) jedoch kann nicht 4e- gewinnen oder verlieren, um eine Edelgaskonfiguration zu erlangen. Deshalb bilden C-Atome Bindungen zu anderen Atomen, indem die aneinander gebundenen Atome Elektronen miteinander teilen. Jedes Atom erhält damit formal ein äusseres Elektronenoktett.
z.B.
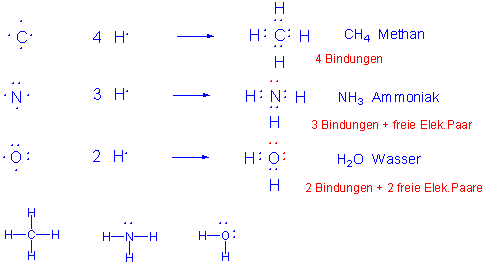
Derartige Bindungen bezeichnet man als kovalente Einfachbindungen. Bei den Zeichnungen nach Lewis werden die Valenzelektronen durch Punkte dargestellt. Einfach dargestellt, werden aneinander gebundene Atome durch gerade Striche zwischen den Atomen symbolisiert. Einsame Elektronenpaare (lone pairs of electrons) stellt man als Doppelpunkte dar, oder lässt sie einfach weg (Kekulé Strukturen).
Die Anzahl der Bindungen, welche ein Atom eingehen kann, wird durch die Zahl seiner Aussenelektronen in Verbindung mit der Edelgasregel festgelegt
Wie entstehen Kovalenzbindungen ? Bindungen entstehen durch In-Phase-Überlappung von Atomorbitalen.
z.B.
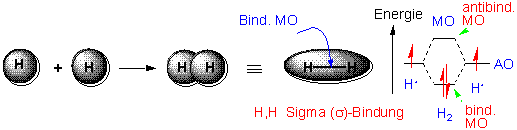
Durch In-Phase-Überlappung der beiden 1s-Orbitale entsteht ein neues Orbital mit niedrigerer Energie als die beiden ursprünglichen Atomorbitale - das bindende Molekülorbital.
Bringt man zwei Wasserstoffatome so nahe zusammen, dass zwischen ihnen eine Bindung geknüpft wird, wird eine Energie von 435 KJ/mol frei. Entsprechend ist zum Aufbrechen einer solche Bindung Energie erforderlich, und zwar ebenfalls 435 KJ/mol (104 Kcal/mol). Diese Energie bezeichnet man als Bindungsdissoziationsenergie ΔH.
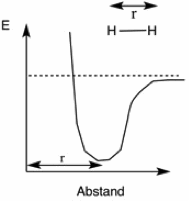
Dissoziationsenergien beziehen sich ausschliesslich auf homolytische Spaltungen. Je nach Art der Bindung und der miteinander verbundenen Atome besitzen sie einen charakteristischen Wert.
Wie sehen die Kovalenzbindungen in komplexeren Molekülen, z.B. im Methan aus ?
Die Bindungsbildung im H2 Molekül lässt sich einfach beschreiben, schwieriger wird die Situation in komplexen organischen Molekülen mit tetravalentem Kohlenstoff. Das soll am Beispiel des Methans demonstriert werden.
Kohlenstoff besitzt als Atom der 4. Hauptgruppe des PSE vier Elektronen in seiner Valenzschale (2s2, 2p2) und kann somit vier kovalente Bindungen z.B. mit Wasserstoff eingehen.
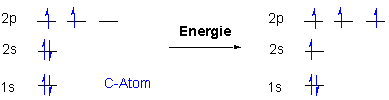
In dieser Elektronenkonfiguration ist C in der Lage vier chemische Bindungen einzugehen. In Lewis Strukturen :
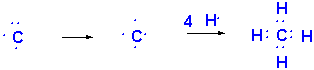
Wie kann man nun die C-H-Bindungen beschreiben? Da Kohlenstoff Elektronen aus zwei Orbitaltypen (2s und 2p) zur Bindungsbildung verwendet, könnte man annehmen, dass Methan zwei Typen von C-H-Bindungen aufweist. Tatsächlich sind aber alle vier C-H-Bindungen identisch und weisen in die Ecken eines regulären Tetraeders. Wie kann man diesen Sachverhalt erklären?
Die Antwort wurde 1931 von Linus Pauling gegeben, indem er zeigte, dass ein s-Orbital und drei p-Orbitale kombiniert (hybridisiert) werden können, um vier gleichwertige Atomorbitale mit tetraedrischer Orientierung zu erhalten. Diese tetraedrischen Orbitale nent man sp3 Hybridorbitale, wobei der Exponent 3 angibt, wieviele Atomorbitale des jeweiligen Typs an der Bildung des Hybridorbitals beteiligt sind (formal s1p3 -> sp3).
Das Konzept der Hybridisierung beschreibt nun wie Kohlenstoff vier gleichwertige tetraedrische Bindungen ausbildet, erklärt jedoch nicht warum. Die Form des Hybridorbitals liefert dafür die Antwort. Wenn ein s-Orbital mit drei p-Orbitalen hybridisiert, sind die resultierenden Hybridorbitale unsymmetrisch hinsichtlich des Atomkerns. Eine der beiden Keulen wird grösser gegenüber der anderen und kann somit besser mit einem anderen Orbital überlappen, um eine Bindung zu bilden. Damit wird deutlich, dass sp3 Hybridorbitale stärkere Bindungen bilden können als unhybridisierte s oder p Orbitale.
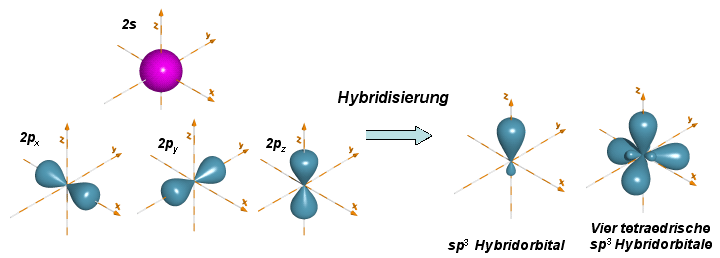
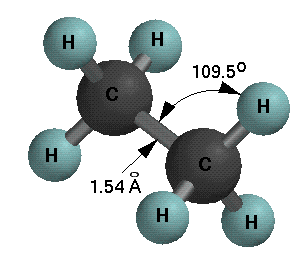
Überlappen nun die vier identischen Orbitale eines sp3 hybridisierten Kohlenstoffatoms mit den 1s Orbitalen von vier Wasserstoffatomen, dann werden vier identische C-H-Bindungen gebildet und ein Methanmolekül liegt vor.
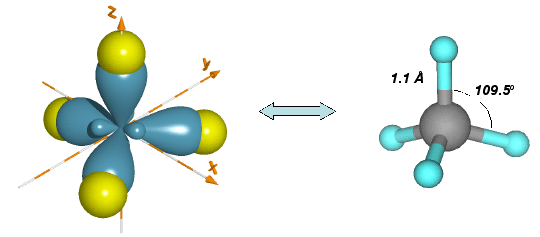
Die C-H Bindung im Methan hat eine Bindungsdissoziationsenergie von 105 kcal/mol, eine Bindungslänge von 1.1 Å. Der H-C-H Bindungswinkel, auch Tetraederwinkel genannt, beträgt 109.5o.
Die sp3-Hybridorbitale können auch mit anderen Orbitalen überlappen. Durch Überlappung mit vier Chlor-p-Orbitalen entsteht beispielsweise Tetrachlormethan CCl4. Auch C-C Bindungen werden durch Überlappung zweier Hybridorbitale gebildet :
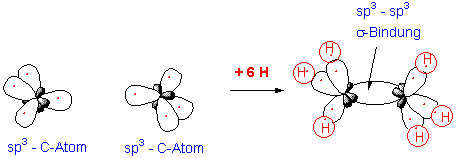
Im Ethan beträgt die C-C Bindungslänge 1.54 Å, die C-C Bindungsdissoziationsenergie 88 Kcal/mol und die Bindungswinkeln sind fast alle 109.5o.
Mit welchen Typen von Orbitalen lässt sich nun die Bindung im Ammoniak und im Wassermolekül beschreiben ?
Aus der Elektronenkonfiguration 1s2 2s2 2p3 des Stickstoffes, ergibt sich dessen Dreibindigkeit. Drei kovalente Bindungen sind zur Erreichung eines Elektronenoktetts nötig. Um mit der beobachteten Molekülstruktur (ein angenäherter Tetraeder) übereinzustimmen, nimmt man eine sp3-Hybridisierung am Stickstoff an.
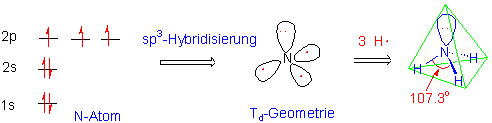
Im vierten sp3-Orbital befindet sich das freie Elektronenpaar. Die N-H Bindungsdissoziationsenergie beträgt 391 KJ/mol (93 Kcal/mol), die Bindungslänge 1.0 Å, und der HNH - Bindungswinkel 107.3o.
Entsprechend lässt sich auch die Bindung im Wassermolekül am besten über sp3-Hybridorbitale beschreiben.
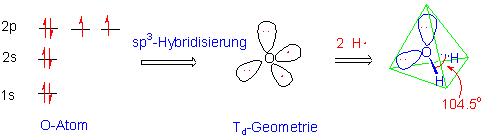
O-H Bindungsdissoziationsenergie = 463 KJ/mol (110 Kcal/mol)
O-H Bindungslänge = 0.96 Å
HOH Bindungswinkel = 104.5o.
Im Ethylen (=Ethen) teilen die zwei C-Atome vier Elektronen. Sie werden durch eine Doppelbindung verknüpft:
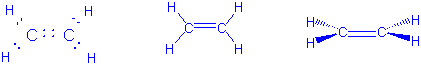
Eine sp3-Hybridisierung kann diese Struktur nicht erklären. Statt dessen wird das 2s-Orbital am C mit nur zwei 2p-Orbitalen hybridisiert, um drei sp2 Hybridorbitale zu bilden. Ein p-Orbital bleibt unverändert:

Wenn zwei sp2-hybridisierte C-Atome sich annähern kann durch Überlappung von zwei sp2-Orbitalen eine σ-Bindung entstehen. Gleichzeitig nähern sich die zwei nicht-hybridisierte p-Orbitale von der Seite an und bilden dadurch eine neue pi (π) Bindung.
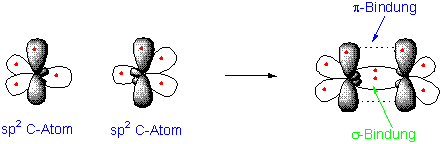
Durch die Überlappung von p-Orbitalen entstehen pi (π)-Bindungen. Die Überlappung der vier übrigen sp2-Hybridorbitale mit 1s Orbitalen des Waserstoffes ergibt dann das Ethylenmolekül :

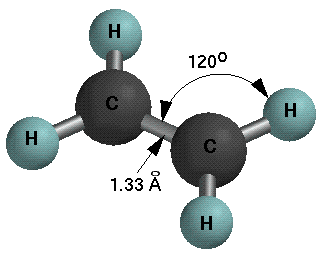
Ethylen besitzt eine flache Struktur mit HCH- und HCC- Bindungswinkeln von 120o. Die C-H Bindungslänge beträgt 1.076 Å und die C-H Bindungsdissoziationsenergie 103 Kcal/mol. Die C=C Bindungslänge ist 1.33 Å (vgl Ethan 1.54 Å) und die Bindungsdissoziationsenergie beträgt 152 Kcal/mol (vgl. Ethan 88 Kcal/mol). Die Doppelbindung ist damit wie erwartet kürzer und stärker als eine C-C Einfachbindung.
Die Carbonylgruppe in Aldehyden, Ketonen und Carbonsäuren enthält eine C=O Doppelbindung. Das Carbonyl-C ist auch sp2-hybridisiert und bildet drei σ-Bindungen. Das vierte Valenzelektron bleibt in einem p-Orbital und wird an einer pi-Bindung zu Sauerstoff beteiligt :
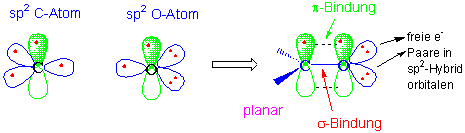
Wie Alkene haben Carbonylgruppen eine flache Struktur und einen Bindungswinkeln von ungefähr 120o.
Kohlenstoff kann auch Dreifachbindungen bilden. Im Acetylen teilen zwei C-Atome sechs Elektronen. Hier entstehen andere Hybridorbitale durch die Mischung von dem 2s-Orbital und einem 2p-Orbital. Zwei sp-Hydridorbitale entstehen und bilden eine lineare Geometrie. Die anderen p-Orbitale stehen senkrecht zueinander :
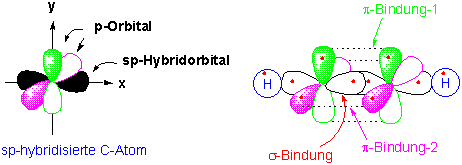
Wenn zwei sp-hybridisierte C-Atome sich annähern, entsteht durch die Überlappung der sp-Hybridorbitale eine starke σ-Bindung und durch die Überlappung der zwei p-Orbitale zwei π-Bindungen (d.h. eine Dreifachbindung). Die übrigen sp-Hybridorbitale können wieder σ-Bindungen mit den 1s-Orbitalen des Wasserstoffs bilden.

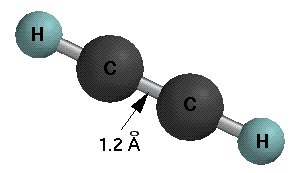
Auf Grund der sp-Hybridisierung ist Acetylen ein lineares Molekül mit einem HCC Bindungswinkel von 180o, einer C-H Bindungslänge von 1.06 Å, einer C-C Bindungslänge von 1.2 Å und Bindungsdissoziationsenergien von 125 Kcal/mol (C-H) und 200 Kcal/mol (C-C).
Sind zwei gleiche Atome durch eine Bindung verknüpft (H-H, CH3-CH3 usw.) so verteilt sich das Bindungselektronenpaar gleichmässig auf beide Atome. Sind dagegen die verknüpften Atome verschieden (z.B. H-Cl, CH3-Cl), so entsteht eine unsymmetrische Elektronenwolke, da eines der Atome die Bindungselektronen stärker an sich zieht als das andere.
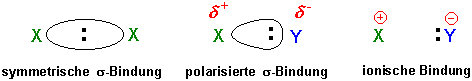
Man nennt das Bestreben eines Atoms, Bindungselektronen anzuziehen, Elektronegativität. Im Periodensystem nimmt die Elektronegativität von "links nach rechts" und von "unten nach oben" zu:
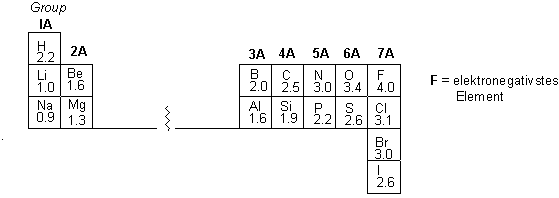
Die Pauling-Elektronegativitäten beziehen sich auf das elektronegativste Atom Fluor, welchem willkürlich der Wert 4 zugeordnet wird. Z.B. die C-Cl Bindung im Chlormethan ist eine polare Kovalenzbindung:
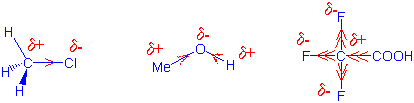
Metallische Elemente an der linken Seite des Periodensystems sind weniger elektronegativ als C:
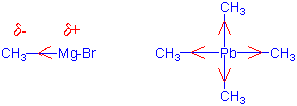
Polarisationseffekte, die durch elektronenanziehende oder -abstossende Atome oder Atomgruppen bewirkt und über σ-Bindungen übertragen werden, heissen induktive Effekte. Je nachdem, ob das "Schlüsselatom" d.h. das elektronen-anziehende bzw. -abstossende Atom eine negative oder positive Partialladung erhält, spricht man von -I oder +I-Effekten. Die "Schlüsselatome" werden oft auch als σ-Akzeptoren (elektronenanziehend) oder σ-Donatoren (elektronen-abstossend) bezeichnet z.B.

Mit wachsender Zahl der Bindungen, d.h. mit zunehmendem Abstand vom Schlüsselatom, nimmt die Wirkung des induktiven Effektes sehr stark ab.