Inhalt Index
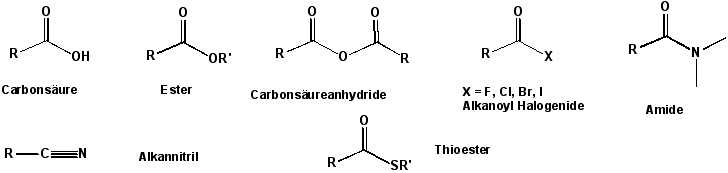
Inhalt IndexIst an das Kohlenstoffatom der Carbonylgruppe eine Hydroxygruppe gebunden, ergibt sich eine neue funktionelle Gruppe, die Carboxygruppe, die für die Carbonsäuren charakteristisch ist. Obwohl es zahlreiche Carbonsäure-Derivate gibt, werden wir hier nur vier in Betracht ziehen. Auch die Nitrilgruppe ist formal das Derivat einer Carbonsäure :
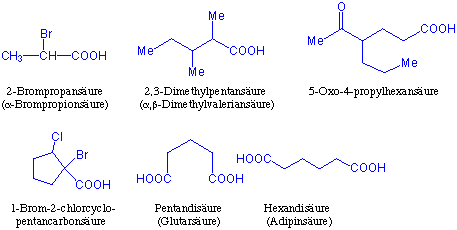
Von vielen Carbonsäuren sind die Trivialnamen gebräuchlich. Im IUPAC-System wird der Name einer Carbonsäure aus dem Namen des Stammalkans durch Anhängen des Wortes -säure abgeleitet. Der Stamm der Alkansäure wird so numeriert, dass der Kohlenstoff der Carboxygruppe die Nummer 1 erhält. Alle Substituenten entlang der längsten Kette, die die funktionelle Gruppe enthält, werden dann mit einem entsprechenden Zahlenvorsatz versehen. Die Carboxygruppe hat eine höhere Priorität als alle anderen bisher diskutierten Gruppen. Gesättigte cyclische Säuren bezeichnet man als Cycloalkancarbonsäuren. Dicarbonsäuren werden systematisch als Alkandisäuren, häufig jedoch mit ihrem Trivialnamen, benannt.
| Carbonsäure (Carboxylic acid) | Acylgruppe (Acyl group) | |||
|---|---|---|---|---|
| Struktur | Name | Natürliches Vorkommen | Name | Struktur |
| HCOOH | Ameisensäure (Formic) | Ameisen | Formyl | HCO- |
| CH3COOH | Essigsäure (Acetic) | Essig | Acetyl | CH3CO- |
| CH3CH2COOH | Propionsäure (Propionic) | Milchprodukte | Propionyl | CH3CH2CO- |
| CH3CH2CH2COOH | Buttersäure (Butyric) | ranzige Butter | Butyryl | CH3(CH2)2CO- |
| CH3(CH2)3COOH | Pentansäure (Valeric) | Baldrianwurzeln | ||
| CH3(CH2)4COOH | Hexansäure (Caproic) | Ziegengeruch | ||
| HOOC-COOH | Oxalsäure | Oxalyl | -OCCO- | |
| HOOC-CH2-COOH | Malonsäure (Malonic) | Malonyl | -OCCH2CO- | |
| HOOC-CH2CH2-COOH | Bernsteinsäure (Succinic) | Succinyl | -OCCH2CH2CO- | |
| CH2=CHCOOH | Acrylsäure (Acrylic) | Acryloyl | CH2=CHCO | |
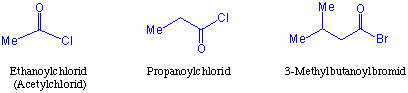
Die Verbindungen des Typs RCOX benennt man nach der IUPAC-Nomenklatur derart, das man an den Namen des Stammalkans der Carbonsäure, von der sie sich ableiten, die Endung -oylhalogenid anhängt. In der noch meist verwendeten Nomenklatur wird der Name aus der Bezeichnung des Stamms der Säuregruppe und der Endung-halogenid gebildet. Das Chlorid der Essigsäure würde dann nach der neuesten Nomenklatur Ethanoylchlorid im anderen Fall Acetylchlorid heissen :
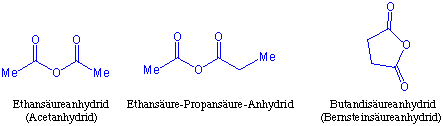
Carbonsäureanhydride entstehen aus den Carbonsäuren durch Dehydratisierung. Entsprechend werden sie auch benannt, indem man das Wort anhydrid einfach an den Namen der Säure anhängt :
Nach der neuesten IUPAC-Nomenklatur bezeichnet man Ester als Alkylalkanoat. Im deutschen Sprachraum werden allerdings drei unterschiedliche Nomenklaturen benützt, z.B.:
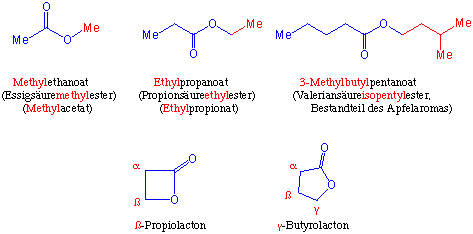
Cyclische Ester bezeichnet man als Lactone.
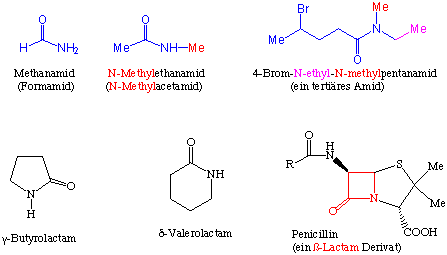
Systematisch bezeichnet man Amide als Alkanamide, bei den Trivialnamen wird an den Wortstamm der Säure die Endung -amid angehängt. Substituenten am Stickstoff werden durch den Vorsatz N- oder N,N-, je nach Anzahl der gebundenen Gruppen gekennzeichnet. Je nach Anzahl der an den Stickstoff gebundenen Gruppen unterscheidet man primäre, sekundäre und tertiäre Amide. Cyclische Amide nennt man Lactame :
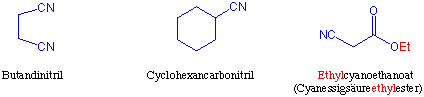
Systematisch bezeichnet man diese Verbindungsklasse als Alkannitrile. Bei dem Trivialnamen wird gewöhnlich an den Wortstamm der Säure die Endung -nitril angehängt. Gelegentlich hängt man auch an den Namen der Alkylgruppe die Endung -cyanid an :
Wie bei Ketonen ist das Carboxyl-Kohlenstoffatom sp2-hybridisiert und deshalb planar :
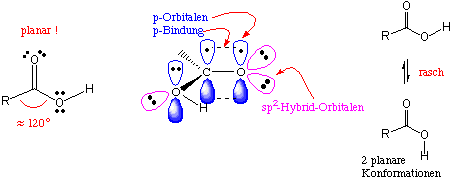
Die Carboxylgruppe ist aufgrund der polarisierbaren Carbonyl-Doppelbindung und der Hydroxygruppe stark polar. Als reine Flüssigkeiten und sogar in recht verdünnten Lösungen liegen Carbonsäuren grösstenteils als über Wasserstoffbrücken gebundene Dimere vor :
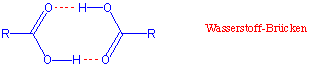
Aufgrund ihrer Fähigkeit, im festen und im flüssigen Zustand Wasserstoffbrücken auszubilden, haben Carbonsäuren relativ hohe Schmelz- und Siedepunkte.
z.B.

Wie schon der Name erkennen lässt, reagieren Carbonsäuren sauer. Das saure Verhalten ist weitaus stärker ausgeprägt als bei den Alkoholen, obwohl das saure Proton in beiden Fällen einer Hydroxygruppe entstammt :

Carbonsäuren sind mittelstarke Säuren : Vgl. HCl und Essigsäure.
| Verbindung | pKa |
|---|---|
| HCl | -7 |
| CCl3COOH | 0.64 |
| HCOOH | 3.75 |
| PhCOOH | 4.19 |
| CH3COOH | 4.72 |
| CH3CH2OH | 16 |
Warum sind Carbonsäuren saurer als Alkohole, wenn beide OH Gruppen besitzen? Vergleichen wir dazu die relative Stabilität von Alkoxid-Anionen und Carboxylat-Anionen:
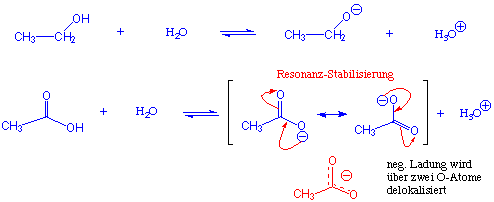
Die negative Ladung in Carboxylgruppen ist über zwei O-Atome delokalisiert. Eine Resonanzstabilisierung des resultierenden Carboxylat-Ions erfolgt.
Wie bei Alkoholen und Phenolen wird die Acidität der Carbonsäure durch Substituenten in Nachbarschaft zur Carboxygruppe beeinflusst :
| Verbindung | pKa | Verbindung | pKa | |
|---|---|---|---|---|
| CH3COOH | 4.72 |  | CH3CH2CH2COOH | 4.9 |
| ClCH2COOH | 2.86 | ClCH2CH2CH2COOH | 4.5 | |
| Cl2CHCOOH | 1.26 | CH3CHClCH2COOH | 4.1 | |
| Cl3CCOOH | 0.64 | CH3CH2CHClCOOH | 3.8 | |
| F3CCOOH | 0.23 |
Woher kommen solche Effekte ? Die Dissoziation einer Carbonsäure ist ein Gleichgewicht-Prozess. Ein Substituent, der das Carboxylat-Anion stabilisiern kann, führt zu einer Steigerung der Acidität, weil der Dissoziationkoeffizient erhöht wird. Elektronenziehende Substituenten in Nachbarschaft zur Carboxygruppe erhöhen deshalb deren Acidität :
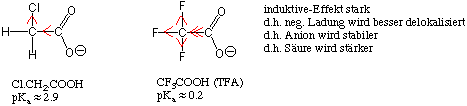
Der induktive Effekt ist weitaus weniger ausgeprägt, wenn sich der Substituent in einiger Entfernung von der funktionellen Gruppe befindet.
Die meisten der Verfahren, die wir hier beschreiben, wurden schon bei der Beschreibung der Chemie anderer funktionellen Gruppen erwähnt.
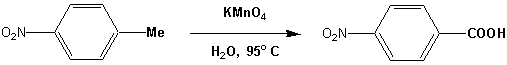
Alkylgruppen an aromatischen Ringen können mit Kaliumpermanganat zu Carboxylgruppen oxidiert werden: (vgl. Kapitel 5.10)
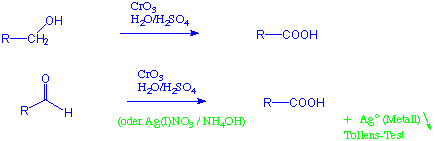
Primäre Alkohole sowie Aldehyde können zu Carbonsäuren oxidiert werden: (vgl. Kapitel 9.7.3)
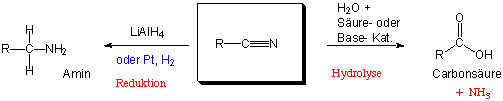
Nitrile werden durch wässerige Säuren oder Basen zu den entsprechenden Carbonsäuren hydrolysiert :
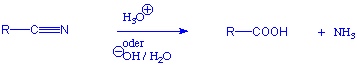
Weil Nitrile oftmals aus Halogenalkanen hergestellt werden, können also Halogenalkane in zwei Schritten zu Carbonsäuren umgewandelt werden :
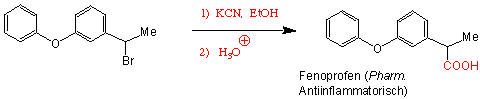
Diese Methode läuft am besten mit primären Alkylhalogeniden. Bei sekundären und besonders bei tertiären Alkylhalogeniden können Eliminierungen auftreten.
11.4.3 Carboxylierung von Grignard Reagenzien
In Kapitel 10.4.3 haben wir gesehen, wie Grignard-Reagenzien unter nucleophiler Addition mit Aldehyden und Ketonen reagieren. Analog wird auch Kohlendioxid von Grignard Reagenzien angegriffen. Es entsteht dabei ein Carboxylat, aus dem man nach wässeriger Aufarbeitung und Ansäuern die Säure erhält :
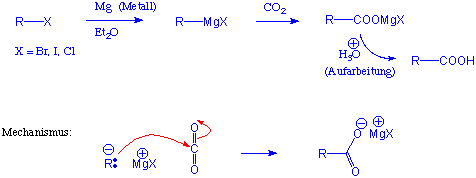
Hier haben wir eine zweite Methode für die Herstellung der Carbonsäuren aus den entsprechenden Halogenalkanen:
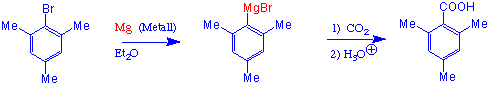
Wie können, ausgehend von Carbonsäuren im Labor Säurechloride, Anhydride, Ester und Amide hergestellt werden ?
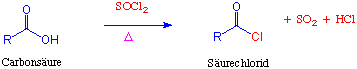
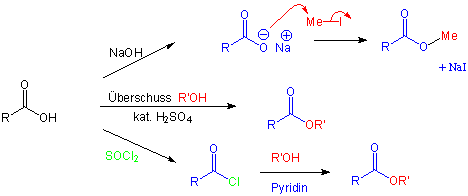
Überführung in Säurechloride
Die Reaktion einer Carbonsäure mit Thionylchlorid (SOCl2) oder Phosphorpentachlorid (PCl5) ergibt die entsprechenden Alkanoylchloride. Dadurch wird die OH-Gruppe durch eine -Cl Gruppe ersetzt :

Der Hydroxysubstituent ist nicht nur bei SN2-, sondern auch bei Additions-Eliminierungs-Reaktionen eine schlechte Abgangsgruppe. Da die Halogene in den Alkanoylhalogeniden gute Abgangsgruppen sind und die benachbarte Carbonylfunktion aktivieren, sind diese Carbonsäure-Derivate wertvolle synthetische Zwischenprodukte bei der Darstellung anderer Carbonsäurederivaten.
Überführung in Säureanhydride
Wie aus dem Namen ersichtlich, leiten sich die Anhydride der Carbonsäuren formal von diesen durch Abspaltung von Wasser ab. Nur bei gewissen cyclischen Dicarbonsäuren ist auf diese Weise leicht eine intramolekulare Wasserspaltung zu cyclischen Anhydriden möglich :
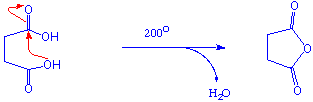
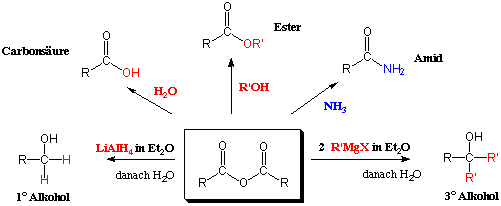
Überführung in Ester
Ester sind die wichtigsten Carbonsäure-Derivate. Wir werden hier zwei Methoden betrachten, nach denen man Ester ausgehend von Carbonsäuren herstellen kann.Eine wichtige Methode ist die nucleophile Substitution (SN2) von Halogenalkanen mit Carboxylat-Ionen :
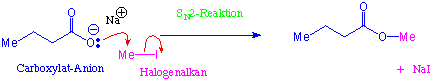
Carboxylat-Ionen sind Nucleophile, die Ester über SN2-Reaktionen bilden, insbesondere wenn die Substrate primäre Halogenalkane sind.
Gibt man eine Carbonsäure und einen Alkohol zusammen, findet keine Reaktion statt. Bei Zugabe katalytischer Mengen einer anorganischen Säure (H2SO4, oder HCl) reagieren jedoch beide Komponenten langsam miteinander, wobei ein Ester und Wasser gebildet werden, z.B.:
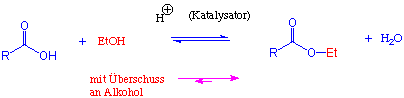
Man kann das Gleichgewicht in Richtung der Produkte verschieben, indem man entweder eine der beiden Ausgangsverbindungen im Überschuss einsetzt, oder indem man den Ester oder das Wasser selektiv aus dem Reaktionsgemisch entfernt. So werden Veresterungen häufig in dem entsprechenden Alkohol als Lösungsmittel durchgeführt (Fischer Veresterung).
Mechanismus :
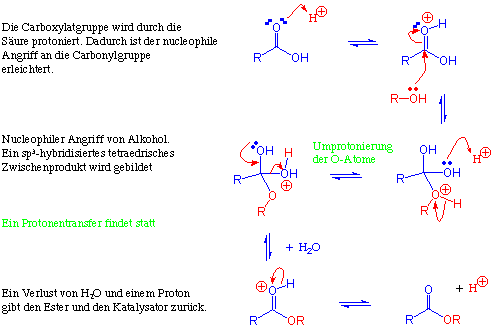
Ein Additions-Eliminierungs-Mechanismus (vgl. 11.6.)
Die Umkehrung der Veresterung ist die Esterhydrolyse (Verseifung). Diese Reaktion wird unter denselben Bedingungen wie die Veresterung durchgeführt, nur dass man, zur Verschiebung des Gleichgewichts einen Überschuss an Wasser verwendet und in einem mit Wasser mischbaren Lösungsmittel arbeitet, z.B.:

Überführung in Amide
Amine sind nucleophiler und basischer als Alkohole, und sie können auf beide Arten mit Carbonsäuren reagieren. Gibt man eine Säure und ein Amin zusammen, bildet sich sofort das Ammoniumsalz (nicht das Amid !):
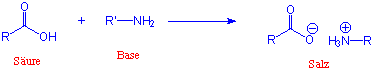
Da das Carboxylat-Anion eine negative Ladung trägt, wird es jetzt von Nucleophilen nicht angegriffen. Nur bei viel höheren Temperaturen verlieren solche Salze H2O und bilden dann Amide. Deswegen ist es meist notwendig über ein Säurechlorid, ein Säureanhydrid oder ein Ester zu gehen, um ein Amid zu bilden.
Reduktion zu Alkoholen
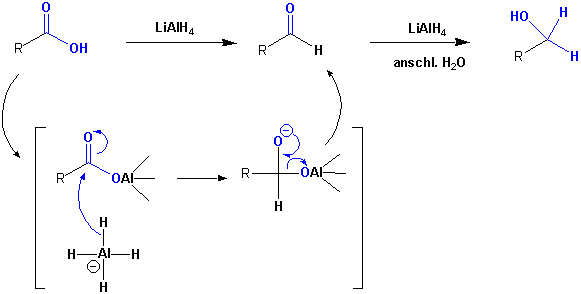
Ein extrem starkes Nucleophil ist Lithiumaluminiumhydrid (LiAlH4). Dieses Reagenz reduziert Carbonsäuren bis zu den entsprechenden Alkoholen, die man nach wässriger Aufarbeitung erhält :
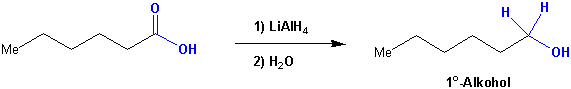
Mechanismus (vgl. Kapitel 10.4.6):
Carbonsäure-Derivaten reagieren an der Carbonylgruppe ähnlich wie Aldehyde und Ketone : der Carbonyl-Kohlenstoff wird von Nucleophilen angegriffen. Ein nucleophiler Angriff auf die Carbonylgruppe verläuft jedoch anders als bei Aldehyden und Ketonen.
Im allgemeinen:
Nucleophile Addition an Aldehyden und Ketonen
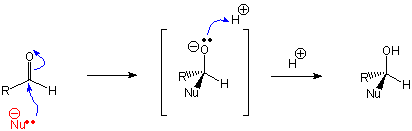
Nucleophile Substitution an Carbonsäure-Derivaten
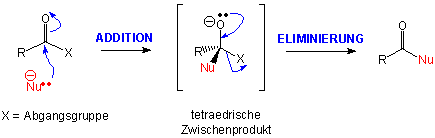
Im Gegensatz zu den Additionsprodukten der Aldehyde und Ketone kann das intermediäre Alkoxid durch Abspaltung von X- zerfallen. Diesen Prozess, in dem das Nucleophil an Stelle der X-gruppe ins Molekül eintritt, nennt man Additions-Eliminierungs-Reaktion.
Vergleiche mit der SN2-Substitution an sp3-Zentren :
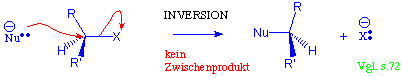
Kein Zwischenprodukt, sondern nur ein einziger Übergangszustand.
Wenn wir die Reaktivität von verschiedener Acyl-Derivaten vergleichen, wird die folgende Reaktivitätsreihenfolge beobachtet :
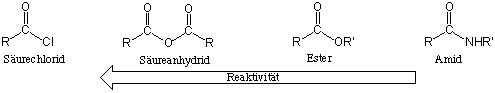
Diese Reihenfolge entspricht teilweise dem Austrittsvermögen und den elektronenziehenen Eigenschaften des an der Carbonylgruppe gebundenen Substituenten sowie der Stärke seines Mesomerieeffekts (bei -OR, -NHR stark; bei -Cl schwächer). Eine wichtige Konsequnez dieser Reaktivitäts-Reihenfolge ist dass es normalerweise möglich ist ein reaktiveres Derivat in ein weniger reaktives Derivat durch eine Additions-Eliminierungs-Reaktion umzuwandeln:
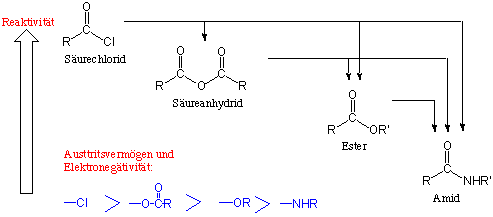
Durch dieses Schema bekommen wir einen Überblick über die Reaktivitat von Carbonsäure-Derivaten.
Erinnern wir uns aber auch daran, dass das Hydroxy-proton einer Carbonsäure sauer reagiert und die meisten Nucleophile basisch sind. Daher kann mit Carbonsäuren selbst eine Säure-Base-Reaktion in Konkurrenz zu dem nucleophilen Angriff treten.
Herstellung
Wir haben gerade gesehen wie Carbonsäuren durch Behandlung mit Thionylchlorid (SOCl2) oder PCl5 die entsprechenden Alkanoylchloride (Säurechloride) ergeben.
Reaktionen
Alkanoylchloride reagieren mit Nucleophilen über einen Additions-Eliminierungs-Mechanismus. Säurechloride sind einige der reaktivsten Carbonsäure-Derivate und lassen sich in zahlreiche andere funktionelle Gruppen überführen. Säurechloride reagieren zum Beispiel sehr rasch mit Wasser und bilden dann Carbonsäuren. Solche Reaktionen sind nicht reversibel :
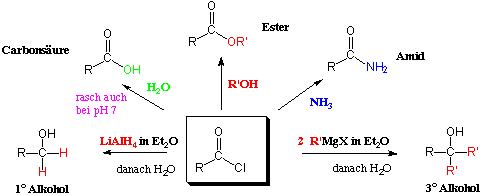
Die Reaktion von Säurechloriden mit Alkoholen verläuft über einen ähnlichen Mechanismus und ist eine sehr gute Möglichkeit zur Darstellung von Estern, z.B.:
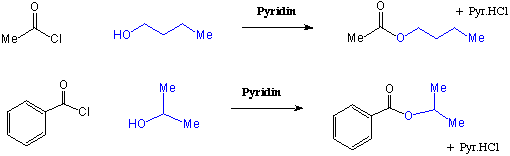
Meist gibt man eine Base ( z.B. Pyridin) zur Neutralisation des als Nebenprodukt entstehenden Chlorwasserstoffs hinzu.
Sekundäre und primäre Amine sowie Ammoniak setzen sich mit Alkanoylchloriden zu Amiden um. Das entstandene HCl wird wiederum durch die zugesetzte Base (die ein Überschuss Amin sein kann) neutralisiert, z.B.:
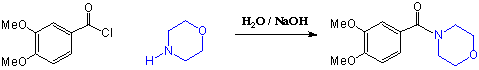
Die Reduktion mit Lithium Aluminium Hydrid (LiAlH4) erfolgt auch über einen Additions-Eliminierungs-Mechanismus (siehe oben Reduktion zu Alkoholen)
Herstellung
Eine Methode zur die Herstellung von Carbonsäureanhydriden ist durch die Dehydratisierung von Carbonsäuren:
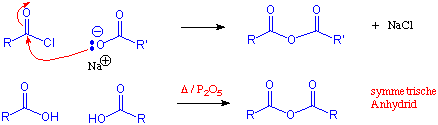
Reaktionen
Die Reaktionen der Carbonsäureanhydride verlaufen - wenn auch weniger heftig - analog zu denen der Alkanoylhalogenide. Die Abgangsgruppe ist ein Carboxylat- anstelle eines Halogenid-Ions.
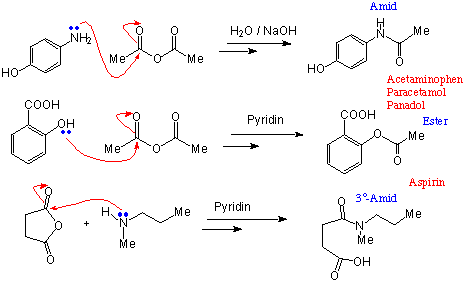
Einige Beispiele folgen :
Die Ester sind die wichtigste Klasse von Derivaten der Carbonsäuren. Viele Ester haben einen charakteristischen angenehmen Geruch. Sie sind wichtige Komponenten von natürlichen und künstlichen Fruchtaromen. Ester langkettiger Carbonsäuren und Alkohole sind die Hauptbestandteile der tierischen und pflanzlichen Wachse. Wachse und Fette gehören zu den Lipiden (Kapitel 17). Sie dienen als "Brennstoff" und Energiedepot und sind Bestandteile biologischer Membranen.
Herstellung
Ester können über die schon erwähnten Methoden ausgehend von Carbonsäuren hergestellt werden:
Reaktionen
Dieselben Reaktionen, die wir bei anderen Acyl-Derivaten gesehen haben, können bei Estern durchgeführt werden. Die Umsetzungen verlaufen aber viel langsamer, sodass meist ein Säure-Base-Katalysator gebraucht wird, um die Reaktion zu beschleunigen.
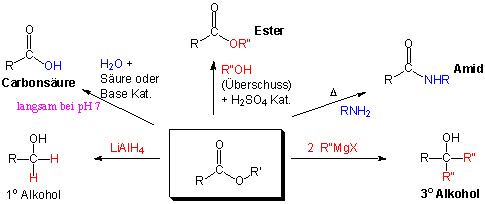
Hydrolyse
Im Gegensatz zu den Alkanoylhalogeniden und den Carbonsäureanhydriden reagieren Ester in Abwesenheit eines Katalysators nicht mit Wasser und Alkoholen. Erhitzt man Ester in einem Überschuss von Wasser in Gegenwart von Mineralsäuren, so HYDROLYSIEREN sie. Der Mechanismus ist die Umkehrung der säurekatalysierten Veresterung. DIE HYDROLYSE von Estern wird auch von Basen katalysiert :
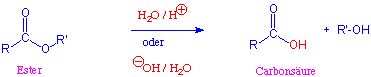
Im Gegensatz zu der säurekatalysierten Hydrolyse ist die basekatalysierte Reaktion kein Gleichgewichtsprozess :
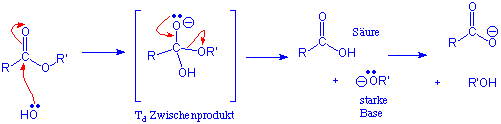
Der letzte Schritt, in dem die Säure in das Carboxylat-Ion überführt wird, ist unter diesen Reaktionsbedingungen irreversibel.
Amide aus Estern (vgl. das Ribosom)
Ester reagieren nur langsam mit den nucleophileren Aminen ohne Zugabe eines Katalysators zu Amiden, z.B.:
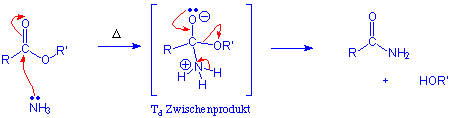
Auch diese Reaktion läuft über einen Additions-Eliminierungs-Mechanismus.
Die Reduktion von Estern zu Alkoholen benötigt 0.5 Äquivalente Lithiumaluminium-Hydride pro Esterfunktion:
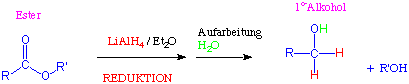
Man kann das Nucleophil hier als Hydrid-Donor (H-) betrachten (vgl. oben).
Mit Grignard Reagenzien
Ester reagieren mit zwei Äquivalenten Grignard-Reagenz zu Alkoholen. Auf diese Weise entstehen aus Ameisensäureestern sekundäre und aus allen anderen Estern tertiäre Alkohole :
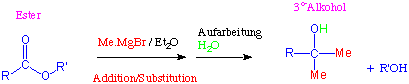
Mechanismus:
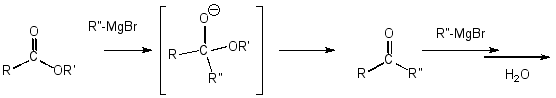
Diese Reaktion verläuft, wie die Reduktion mit Lithiumaluminiumhydrid, über einen nucleophilen Additons-Eliminierungs-Mechanismus bis zu einem Aldehyd und dann weiter über eine nucleophile Addition bis zum Alkohol.
Die Carbonylgruppe der Carbonsäureamide wird von allen Carbonsäure-Derivaten am wenigsten leicht von Nucleophilen angegriffen. Die Amide sind aufgrund der besonderen Fähigkeit des freien Elektronenpaars am Stickstoff, in Resonanz zu treten, die reaktionsträgsten Carbonsäure-Derivate :
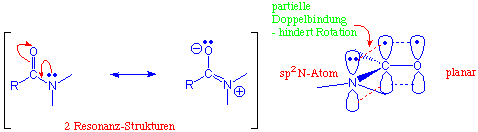
Aus diesem Grund sind Amidgruppen PLANAR ! (vgl. Peptide und Proteine).
Daher sind für nucleophile Additions-Eliminierungs-Reaktionen an Amiden energische Bedingungen (hohe Temperatur) erforderlich.
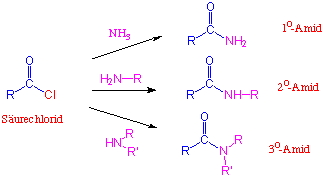
Herstellung
Amide werden normalerweise ausgehend von Säurechloriden (oder Anhydriden) und einem entsprechenden Amin hergestellt :
Reaktionen - HYDROLYSE
So erfolgt eine Hydrolyse beispielsweise nur bei langem Erhitzen in stark saurer (wässriger HCl) oder basischer (Natronlauge)wässriger Lösung :
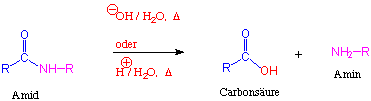
Mechanismus:
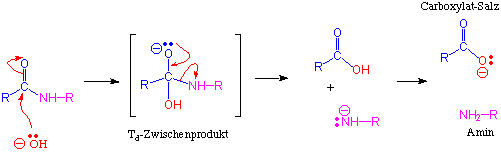
In wässriger Lösung bei pH7 werden Amide mit einer Halbwertszeit von ca. 500 Jahre (!) hydrolysiert.
Nitrile, R-CN, rechnet man zu den Derivaten der Carbonsäuren, weil der Kohlenstoff in den Nitrilen in derselben Oxidationsstufe wie in der Carboxylgruppe vorliegt, und weil sich Nitrile leicht in andere Derivate von Carbonsäuren überführen oder aus ihnen darstellen lassen.
In den Nitrilen sind beide Atome der funktionellen Gruppen sp-hybridisiert, das freie Elektronenpaar am Stickstoff besetzt das sp-Hybridorbital:
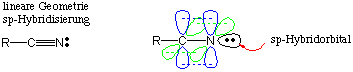
Die elektronenziehende Kraft des N-Atoms in der Nitrilgruppe lässt sich über eine dipolare Resonanzstruktur darstellen .
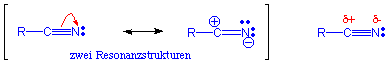
Das freie Elektronenpaar an N kann auch leicht protoniert werden.
Herstellung
Die einfachste Methode Nitrile herzustellen ist durch die SN2-Reaktion an Halogenalkanen, z.B.:
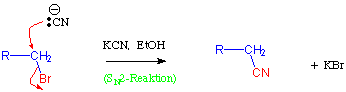
Reaktionen
Ein Vergleich zwischen Carbonyl-Verbindungen und Nitrilen zeigt eine grosse Ähnlichkeit in ihrer Reaktivität gegenüber Nucleophilen. Die wichtigsten chemischen Eigenschaften sind :
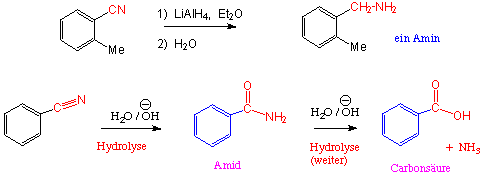
Beispiele :
Die radikalische Polymerisierung von Alkenen haben wir schon betrachtet. Die Gewinnung von Polyethylen, PVC und verwandten Polymeren läuft über Kettenreaktionen (Kettenwachstumspolymerisation). Stufenwachstumspolymere entstehen durch eine Reaktion zwischen zwei unterschiedlichen Monomeren. Hier handelt es sich oftmals um eine nucleophile Acyl-Substitutionsreaktion. Einige Beispiele folgen :
| Monomere | Strukturen | Handelsname | Anwendung |
|---|---|---|---|
| Adipinsäure | HOOH-(CH2)4-COOH | Nylon 66 | Fasern Kleider Reifen-Korde |
| Hexamethylendiamin | H2N-(CH2)6-NH2 | ||
| Ethylenglycol | HO-CH2CH2-OH | Dacron Terylen Mylar | Fasern Kleider Reifen-Korde |
| Dimethylterephthalat | 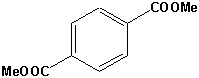
| ||
| Caprolactam | 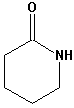 | Nylon 66 Perlon | Fasern andere Artikel |
| 1,4-Benzoldicarbonsäure | 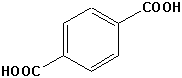 | Kevlar | Ski Kugelsichere Westen |
| 1,4-Benzoldiamin | 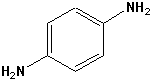
| ||
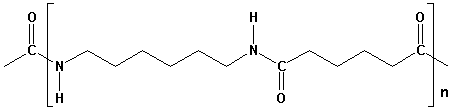 | Nylon 66 | ||
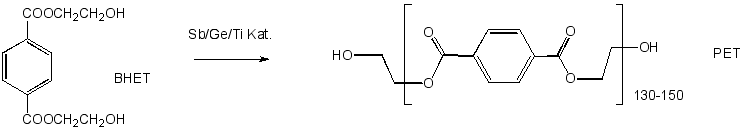
Die PET-Trinkflaschen bestehen aus Polyethylen-Terephthalat. Dieses Polymer wird in zwei Stufen hergestellt. Zuerst wird Ethylenglykol und Terephthalsäure (oder Dimethylterephthalat) zu bis-(2-Hydroxyethyl-terephthalat (BHET) umgesetzt. Danach wird BHET mit ein Sb/Ge/Ti-Katalysator polymerisiert. Momentan wird jährlich ca. 9.5 mill Tonnen PET produziert.
In der Natur werden Säurechloride und Carbonsäureanhydride nicht verwendet (warum nicht ?). Nucleophilen Acyl-Substitutionsreaktionen finden trotzdem häufig in dem Stoffwechsel statt. In der Natur werden aber Thiolester anstelle von Säurechloriden oder Anhydriden verwendet. Wenn wir die pKa-Werte von Alkylthiole betrachten, können wir feststellen, dass sie in ihrer Acidität zwischen Alkoholen und Carbonsäuren liegen:

Dass heisst, ein Thiolat-Anion ist nicht nur ein sehr gutes Nucleophil, es ist auch in nucleophilen Acyl-Substitutionsreaktionen eine sehr gute Abgangsgruppe. In ihrer Reaktivität liegen Thioester zwischen Carbonsäureanhydriden und normalen Estern.
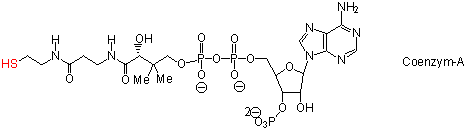
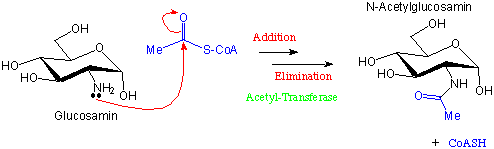
Acetyl-CoA wird in der Natur oftmals (aber nicht ausschliesslich) als Acetylierungs-Reagenz eingesetzt:
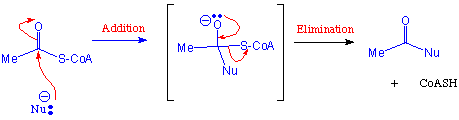
Ein Beispiel findet man in der Biosynthese von N-Acetylglucosamin, einem wichtigen Bestandteil von bakterielle Zellmembranen :
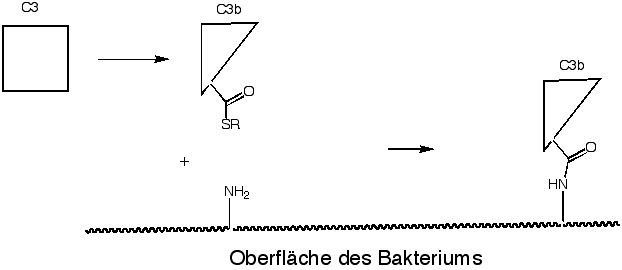
Thioester spielen eine sehr wichtige Rolle im Immunsystem - in der sogenannten Komplementkaskade. Das Plasmaprotein C3b enthält eine Thioestergruppe. Durch eine Posttranslationale-Modifikation wird ein Glutaminrest in C3b in einen Thioester umgewandelt. Die Thioestergruppe ist sehr reaktiv, und kann z.B. mit Nucleophilen (Alkohol- oder Amin-Gruppen) auf der Zelloberfläche reagieren. Am besten reagiert C3b mit Bakterien oder Viren. Dadurch wird die Oberfläche des Mikrorganismus mit vielen Kopien von C3b dekoriert. Danach binden andere Proteine aus der Komplementkaskade an dieses membrangebundene-C3b und schliesslich wird die Membran des Mikroorganismus zerstört.