
 Inhalt Index
Inhalt IndexDas Proton einer starken Säure kann sich unter Bildung eines Carbeniumions an eine Doppelbindung addieren. Wenn ein geeignetes Nucleophil vorhanden ist, bildet sich, insbesondere bei tiefen Temperaturen, das Produkt einer elektrophilen Addition an die Doppelbindung :
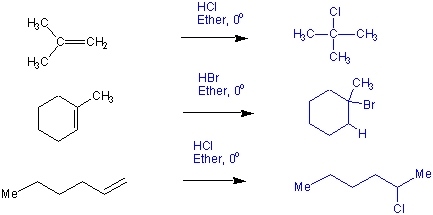
Additionen von HX an unsymmetrische Doppelbindungen sind meistens regioselektiv. z.B.:
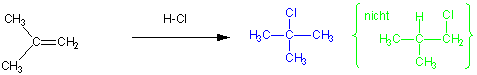
Schon an diesen Beispielen erkennt man, dass, wenn die an der Doppelbindung beteiligten Kohlenstoffatome nicht den gleichen Substitutionsgrad haben, das Proton (Elektrophil) des HX an das weniger substituierte Kohlenstoffatom gebunden wird (to him that hath shall be given !). Dieser Befund ist die Regel von Markovnikov.
Für Alkene, die an beiden sp2-Kohlenstoffatomen ähnlich substituiert sind, sind Produktgemische zu erwarten :
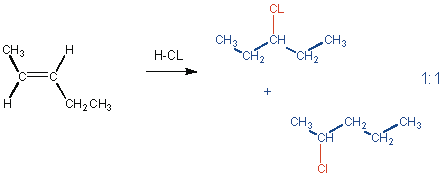
Wie kann man diese Regel erklären ?
Die Regel kann mit Hilfe unserer Kenntnisse über den Mechanismus der elektrophilen Addition von H+ an Alkene und der relativen Stabilität der so gebildeten Carbeniumionen erklärt werden . z.B.:
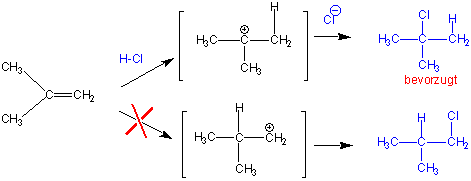
Im ersten Schritt greift das π-System das Proton unter Bildung eines Carbeniumions an. Die Regiochemie der Reaktion wird von diesem Schritt bestimmt, denn wenn das Carbeniumion erst gebildet ist, erfolgt der Abfang durch Cl- schnell.
Messungen in der Gasphase zeigten, dass die Stabilität von Carbenium-Ionen mit zunehmender Alkylsubstitution zunimmt :
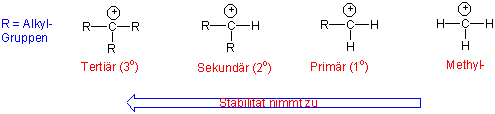
Die Stabilisierung kann auf die induktiven Effekte der Alkylgruppen,
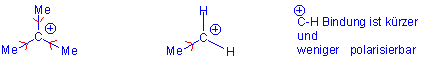
aber auch auf die Hyperkonjugation zurückgeführt werden :
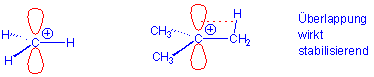
Hyperkonjugation beruht im wesentlichen auf dem Elektronenschub eines Alkylsubstituenten zu einem elektronenarmen Zentrum. Aufgrund dieser Wirkung gilt die Alkylgruppe als "elektronenliefernd" und kann benachbarte positive Ladungen stabilisieren.
Wenn wir die Hydrochlorierung von 2-Methylpropen betrachten, können die beiden denkbaren Wege der Addition in einem Energiediagramm abgebildet werden :
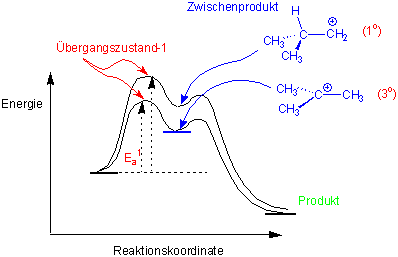
Der Übergangszustand-1 (TS1), der zum energetisch ungünstigeren primären Carbokation führt, liegt energetisch höher als der Übergangszustand 2 (TS2), der zum tertiären Carbokation führt, d.h. die zweite Variante sollte schneller ablaufen.
Für Alkene wie 2-Penten sind Produktgemische zu erwarten, weil Carbeniumionen vergleichbarer Stabilität gebildet werden.
Wenn man ein Alken einer wässerigen Lösung einer Säure aussetzt, die ein schwach nucleophiles Gegenion besitzt, wie z.B. H2SO4, übernimmt das Wasser die Rolle des abgefangenden Nucleophils. Insgesamt werden so die Bestandteile des Wassers addiert . z.B.:
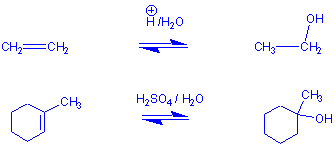
Mechanismus :
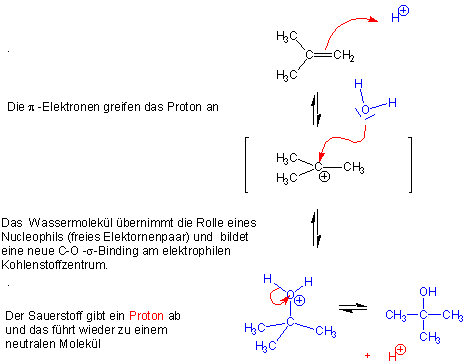
In Gegenwart einer Säure etabliert sich jedoch ein Gleichgewicht zwischen Alkoholen und Alkenen. Dieses Gleichgewicht kann nach beiden Seiten verschoben werden, zum Alken (Dehydratisierung) oder zum Alkohol (Hydratisierung). Bei tieferen Temperaturen, wenn ein grosser Überschuss an Wasser vorhanden ist, ist der Alkohol normalerweise das überwiegende Produkt.
Jährlich werden über 300,000 Tonnen Ethanol in den USA durch die Hydratisierung von Ethylen produziert (andere Verfahren !).
Halogene wie Chlor, Brom und Jod sind auch elektrophile Reagenzien, die sich an eine Doppelbindung addieren können, und dabei eine vicinale Dihalogenide liefern. z.B.:
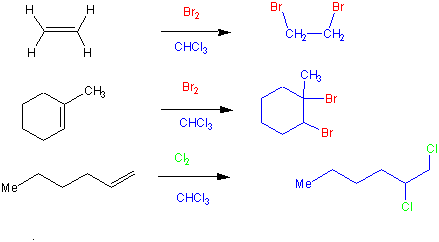
Jährlich werden über 5 Millionen Tonnen 1,2-Dichlorethan hergestellt. Es wird als Lösungsmittel verwendet und für die Darstellung von Polyvinylchlorid (PVC) gebraucht.
Mechanismus :
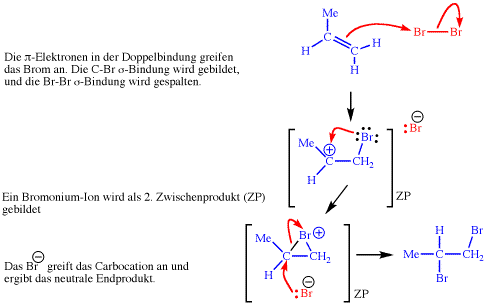
Dieser Mechanismus kann den beobachteten stereochemischen Verlauf solcher Reaktionen erklären, z.B.:
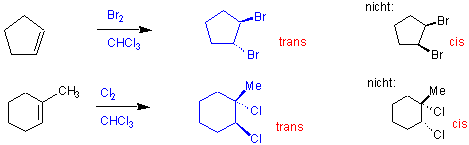
Ausserdem zeigen andere Erfahrungen, dass ein elektronegatives Halogenatom mit dem benachbarten, positiv geladenen Kohlenstoff leicht in Wechselwirkung tritt, so dass ein cyclisches Halogenonium-Ion entsteht :
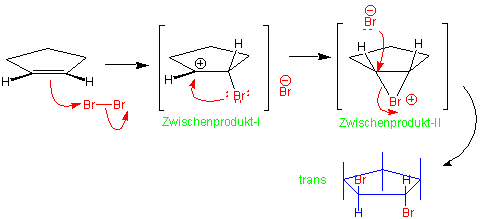
Nun kann im zweiten Schritt die Addition nur von der dem Bromatom entgegengesetzten Seite (vgl. SN2-Reaktion später) her folgen, so dass allein das anti-Produkt gebildet werden kann.
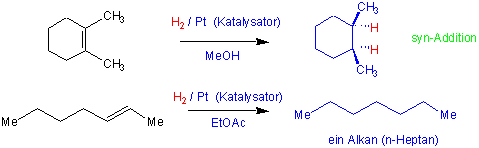
i) Hydrierung (Reduktion)
Die Addition von Wasserstoff an Doppelbindungen verläuft ziemlich stark exotherm. Aber nur bei Verwendung von Übergangsmetall-Katalysatoren ( Pd, Pt oder Ni z.B.) ist die Hydrierung möglich. Die Ausbeuten sind meist nahezu quantitativ. Die beiden Wasserstoffatome werden in den weitaus meisten Fällen von derselben Seite des Substrates addiert (syn-Addition) :
ii) Epoxidierung (Oxidation)
Oxirane (Epoxide) können durch die Reaktion von Alkenen mit Persäuren gewonnen werden. z.B.:
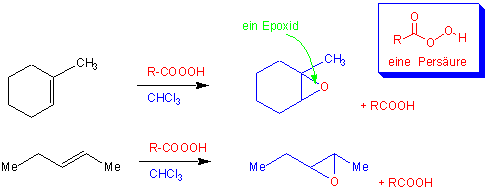
(Vorsicht-Aminogruppen und Thiogruppen werden auch mit Persäuren leicht oxidiert).
Die Behandlung von Epoxide mit Wasser und Säure-oder Basenkatalyse führt unter Ringöffnung zu vicinal Diolen (vgl. später).
iii) Oxidation mit Osmiumtetraoxid
OsO4 reagiert unter neutralen Bedingungen mit Alkenen unter Bildung der entsprechenden vicinalen syn-Diole , z.B.:

Alkene können unter geeigneten Bedingungen mit ihresgleichen reagieren, wobei die ungesättigten Zentren des Alken-Monomeren unter Bildung von Dimeren, Trimeren, Oligomeren und schliesslich Polymeren verbunden werden. Solche Prozessen sind von grosser industrieller Bedeutung : z.B.
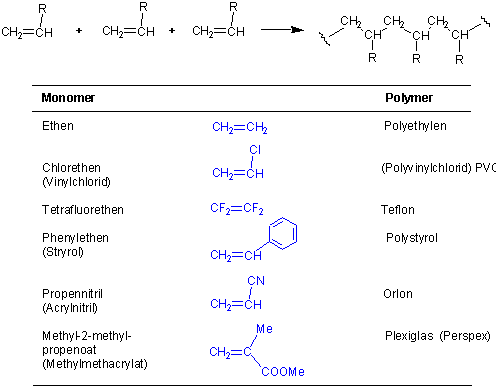
Säurekatalysierte Polymerisationen werden mit H2SO4, HF oder BF3 als Initiatoren durchgeführt. Da Kationen als Intermediate auftreten, werden sie kationische Polymerisationen genannt. Andere häufig gebrauchte Methoden sind radikalische, anionische und metallkatalysierte Polymerisationen.
Nomenklatur: Die IUPAC-Regeln zur Benennung von Alkenen werden auch auf Alkine angewandt, wobei die Endung -in die Endung -en der Alkene ersetzt:
Alkine der allgemeinen Struktur R-C-C-H heissen terminal Alkine, wogegen solche der allgemeinen Struktur R-C-C-R' als interne Alkine bezeichnet werden.
Struktur und Bindung
Die Kohlenstoffatome sind sp-hybridisiert, und die vier einfach besetzten p-Orbitale bilden zwei zueinander senkrecht stehende π-Bindungen:

Da beide Kohlenstoffatome des Ethins sp-hybridisert sind, ist seine Struktur linear.